Estas últimas dos semanas no tuvimos clase de laboratorio y por tanto, no hiciomos prácticas. Acabamos de estudiar el átomo y aprendimos a dibujarlo. Después empezamos con la tabla Periódica. Al principio, no se porque, desde principio de curso, yo le tenía miedo, creía que sería complicado, que no lo entendería... Pero cuando empezamos a darle, me sorprendí, porque es muy, pero que muy fácil, todo en la tabla Periódica concuerda y todo es muy fácil y ligero a la hora de aprender.
Hoy, por fin fuimos al laboratorio y hicimos 3 prácticas que me encantaron:
1- Cromatografía: esta práctica fue la que a mi personalmente más me gustó, pues fue la más creativa, donde podias exponer tu creatividad...
2- Separacion aceite de agua: Esta práctica también me pareció hermosa ,aunque fue una de las más fáciles, creo que nos sentimos orgullosos de nosotros mismos al poder hacerlo sin ningun problema.
3- Separacion del Vodka en agua y alcohol: Este fue el experimento más técnico y más científico que hemos hecho, pero aún así, fue impresionante ver como se producía la condensación, a mi, me ha parecido algo imcreíble
Espero que hayan más dias con tantas prácticas como hoy.
miércoles, 17 de febrero de 2016
LEY DE GAY-LUSSAC
Esta ley establece la relación entre la presión y
la temperatura de un gas cuando el volumen es constante, es decir: si aumentamos la temperatura,
aumentará la presión y si disminuimos la temperatura,
disminuirá la presión. Esto quiere decir que:

Al igual que en la ey de Charles, las Tº se expresan siempre en Kelvin (K).
Según la teoria cineticomolecular, tenemos que, al aumentar la Tº las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el volumen es constante y no puede variar.
Al igual que en la ey de Charles, las Tº se expresan siempre en Kelvin (K).
Según la teoria cineticomolecular, tenemos que, al aumentar la Tº las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el volumen es constante y no puede variar.
martes, 16 de febrero de 2016
LEY DE CHARLES
La ley de Charles trata la relación entre el volumen y la temperatura de una
muestra de gas a presión constante. Cuando tenemos estas características, ocurre lo siguiente: si aumenta
la temperatura ,el volumen del gas también aumenta y si disminuye la Tº, al volumen le pasa lo mismo. Esto se refiere a que, al encontrarnos con un problema, si nos dice que la temperatura aumenta 4 veces, al volumen le pasará lo mismo. Enunciando matemáticamente la ley, tenemos:
Explicandolo según la teoria cineticomolecular: Si tenemos una cantidad de moleculas a una presión constante, y la temperatura aumenta 20ºC, estas empezarán a ir más rápido y presionando contra la pared del recipiente aumentando su volumen. Y si la Tº disminuye, las moleculas irán más despacio, ya no presionaran contra las paredes del recipiente, y provocarán la disminución de su volumen.
Y despejando la T: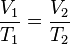
En la ley de Charles, las unidades de Tº son muy importantes, pues solo se puede medir en Kelvin (K).
Explicandolo según la teoria cineticomolecular: Si tenemos una cantidad de moleculas a una presión constante, y la temperatura aumenta 20ºC, estas empezarán a ir más rápido y presionando contra la pared del recipiente aumentando su volumen. Y si la Tº disminuye, las moleculas irán más despacio, ya no presionaran contra las paredes del recipiente, y provocarán la disminución de su volumen.
domingo, 7 de febrero de 2016
LEY DE BOYLE
La ley de Boyle es una de las leyes de los gases que relaciona el volumen y la presión de un gas mantenido a una temperatura constante. La ley de Boyle dice que cuando la temperatura de un gas es constante, si la presión aumenta, el volumen disminuye; y si la presión disminuye, el volumen aumenta. Esto quere decir que, en un problema, Si la presion se multiplica por 3, el volumen se dividirá por ese mismo número, eso quiere decir que son inversamente proporcionales.
Enunciando matemáticamente esta ley, tendríamos que:
TºConstante= P·V= constante
TºConstante= P1·V1 = P2·V2
Según la teoria cineticomolecular, si la Tº de unas partículas es constante, si el volumen aumenta, las moleculas tendrán más espacio para moverse, y chocarán menos veces con las paredes del recipiente por lo cual la presión disminuirá, y, al contrario, si el volumen disminuye, habrá menos espacio para que las moleculas se muevan, por lo cual, las moleculas chocarán más veces contra las paredes del recipiente, haciendo que aumente la presión.
Enunciando matemáticamente esta ley, tendríamos que:
TºConstante= P·V= constante
TºConstante= P1·V1 = P2·V2
Según la teoria cineticomolecular, si la Tº de unas partículas es constante, si el volumen aumenta, las moleculas tendrán más espacio para moverse, y chocarán menos veces con las paredes del recipiente por lo cual la presión disminuirá, y, al contrario, si el volumen disminuye, habrá menos espacio para que las moleculas se muevan, por lo cual, las moleculas chocarán más veces contra las paredes del recipiente, haciendo que aumente la presión.
Suscribirse a:
Entradas (Atom)


